Aandoeningen
Heup
Kraakbeenletsels aan de heup
Hieronder vindt u een zeer gedetailleerde beschrijving van kraakbeenletsels en de meest up-to date informatie ivm behandelingstechnieken. Deze informatie wordt u aangeboden voor de geïnteresseerde in dit domein.
Samenvattend kunnen we stellen dat kraakbeenletsels moeilijk te behandelen zijn omdat volwassenen geen kraakbeen aanmaken. Bij heling van letsels treedt littekenkraakbeen op (dit noemen we fibrocartilago): dit is geen echt kraakbeen en heeft ook niet dezelfde belastbaarheid.
Kraakbeenbehandelingen hebben enkel nut bij gelokaliseerde letsels, niet bij arthrose (slijtage van het gewricht).
Kraakbeenbehandelingen zijn vaak nuttig bij jonge en zeer jonge mensen (<40-45 jaar).
De dienst orthopedie heeft een bijzondere expertise in het behandelen van kraakbeenletsels bij jonge volwasssenen en sporters. Dr Somers is al jarenlang expert in het arthroscopisch behandelen van kraakbeenletsels in de heup, en maakt gebruik van de nieuwste technieken zoals AMIC en stamcelconcentraat dmv BMAC. In de uitgebreide tekst hieronder geeft hij meer uitleg voor de geïnteresseerde lezer.
Update kraakbeen: Wat?
Kraakbeenletsels bij volwassenen komen frekwent voor. Zij kunnen het gevolg zijn van een rechtstreeks trauma, maar ook door overbelasting (“overload”) of mechanische (beenderige) impingement.
Kraakbeen of “cartilago” heeft van nature geen volledige helingscapaciteit bij volwassenen, en dit zoals de meeste weefsels in het menselijk lichaam. Bij het spontane natuurlijke helingsproces wordt “fibrocartilago” aangemaakt; de collageen vezels zijn van een ander type en hebben een mindere belastingscapaciteit. Uiteindelijk leiden kraakbeenletsels vaak tot arthrose. Dit helingsproces en deze evolutie zijn goed gekend en bestudeerd geweest.
De voorbije 20 jaar is enorm veel wetenschappelijk onderzoek uitgevoerd ivm kraakbeenheling, en is er een lange zoektocht bezig om te zorgen dat patiënten met kraakbeenletsels een betere toekomst tegemoet gaan. Kern hierbij is om het kraakbeendefect beter te laten helen, liefst met vorming van hyalien kraakbeen ipv littekenkraakbeen of zgn fibrocartilago.
Het is duidelijk geworden dat de heling van het kraakbeenletsel de prognose bepaalt voor de patiënt, zowel qua symptomatologie in het dagelijkse leven als in de sporthervatting en het niveau van dit laatste. Factoren en behandelingen die de biologie van het kraakbeen reparatie proces beïnvloeden spelen hierbij een steeds grotere rol. Hierbij spelen matrices en celtherapieën een steeds grotere rol.
Er is ook meer en meer inzicht in de helingscapaciteiten van kraakbeenletsels in relatie tot de grootte van het letsel en tot de inherente (leeftijdsgebonden) persoonlijke helingscapaciteiten. In de heup weten we bv dat full-thickness letsels in het acetabulum < 100 mm2 een gunstige helingstendens vertonen, terwijl grotere duidelijk minder gunstig zijn, en letsels > 500mm2 een bijzonder ongunstige prognosis hebben. Dezelfde gegevens zijn voorhanden in de knie.
Daarnaast is in het laatste decennium meer inzicht gekomen in de mechanische factoren die een rol spelen bij het ontstaan en de genezing van kraakbeen letsels.
In de knie en de enkel spelen het axiaal alignement een grote rol, in de heup is de aanwezigheid van beenderige impingement een key factor.
De belangrijkste oorzaak van belangrijke kraakbeenletsels in de heup bij patiënten (Femoro Acetabular Impingement). Veruit de meeste van deze kraakbeenletsels bevinden zich acetabulair, aan de rand, al dan niet met disruptie van de chondrolabrale junctie. Dit is de zone waar de letsels ontstaan door het mechanisch frictiesyndroom bij cam-type impingement (shearing forces). Dit is ook de zone waar bij het stappen en lopen de meeste krachten zich concentreren (load bearing area) en er dus een enorm hoge belasting per oppervlakte eenheid optreedt.
In de knie komen de kraakbeenletsels bij jonge patiënten het vaakst voor bij ligamentaire letsels (zoals kruisbandletsels), en dus bij instabiliteit, en ook bij malalignement. Vaak is er ook geassocieerde meniscale pathologie.
In de enkel situeren de letsels zich meestal thv de talus, en zijn ook vaak geassocieerd met malalignement of instabiliteit.
De meeste klinische studies ivm de behandeling van kraakbeenletsels over de voorbije 20 jaar heeft plaatsgevonden in de knie, en dit om vele redenen. Een van de belangrijkste redenen is het feit dat de arthroscopische evaluatie en behandeling van articulaire letsels van de knie altijd al heeft voorgelopen op de andere gewrichten, mede door de betere toegankelijkheid van dit gewricht, en ook door de hogere prevalentie van sportletsels in de knie.
Het is pas sedert een tiental jaren dat FAI erkend wordt als de belangrijkste oorzaak van kraakbeenlijden en uiteindelijk arthrosis van het heupgewricht. Zowel de open als arthroscopische behandeling van FAI met femoroplastiek (cam-type FAI) en acetabuloplastiek (pincer-type FAI) worden algemeen aanvaard in de orthopedische wereld. Belangrijkste probleem in de behandeling blijft echter het kraakbeendefect.
Een van de belangrijkste problemen in de behandeling en diagnosis van FAI blijft de bedroevende sensitiviteit van de technische onderzoekingen. Alhoewel het kraakbeen goed kan gevisualiseerd worden in de knie, met zelfs excellente correlatie tussen de klinische peroperatieve bevindingen en de verscheidene NMR-technieken, waaronder T2-mapping, dGEMRIC (delayed Gadolinium Enhanced MRI of the Cartilage) en arthro CT of arthro NMR, is dit totaal niet het geval in de heup. Dit heeft 2 redenen: enerzijds de mindere toegankelijkheid van NMR tot het heupgewricht, en anderzijds het verschillend karakter van de typische kraakbeenletsels in de heup. Deze laatste ontstaan immers door “shear-forces”, en geven aanleiding tot delaminatie met initieel afwezigheid van fissuren en dus tot afwezigheid van contraststof in de zone van delaminatie. Een recente multicenter studie aan UGent, waarbij de peroperatieve bevindingen ivm de toestand van het kraakbeen in het heupgewricht tijdens heuparthroscopie, uitgevoerd door “highly experienced” heuparthroscopisten, getoetst werden aan de preoperatieve (arthro-)NMR resultaten, toonde slechts een correlatie van 50% accuraatheid tot het detecteren van kraakbeenletsels. Het stelt ons dus voor het probleem dat in vele gevallen geen accurate beoordeling van de kraakbeenletsels mogelijk is in de preoperatieve fase. De correcte informatie bereikt de chirurg dus maar op het moment van de arthroscopie, en dit stelt ons voor het probleem dat behandelend chirurg en patiënt voor de operatie dienen te overleggen wat de behandelingsstrategieën zullen zijn tijdens de ingreep (consent van behandeling).
Update kraakbeen: Hoe behandelen?
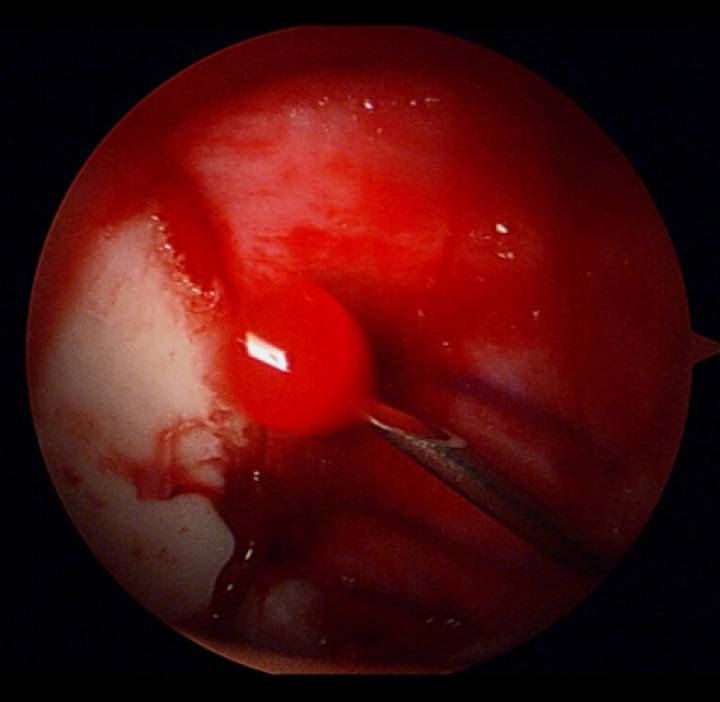
Alhoewel de techniek van “microfracturing” (ook wel “icepicking” genoemd) nog steeds de “gouden standaard” in de behandeling van full thickness kraakbeenletsels beschouwd wordt, komt dit de laatste jaren steeds meer onder druk. Microfracturing werd beschreven door Steadman en Hawkins, na initiële dierproeven (paarden), in de knie. De techniek maakt gebruik van de rekrutering van stamcellen uit het subchondrale bot van het kraakbeendefect. Het is voldoende bewezen dat de “heling” die bekomen wordt, bestaat uit fibrocartilago, en niet uit hyalien kraakbeen. Philippon beschreef de resultaten van deze techniek in de heup. Het betrof een studie van 9 patiënten, waarbij een relook arthroscopie werd uitgevoerd, en eveneens fibrocartilago werd aangetoond min 1 jaar na de index ingreep. Er zijn de laatste jaren meer en meer aanwijzingen dat microfracturing nadelig kan zijn voor verdere behandelingen in de toekomst. Daarenboven is er sterke twijfel gerezen of de techniek wel toepaspaar is op de acetabulaire kraakbeenletsels die gezien worden in het kader van FAI. Het beschadigen van de subchondrale plaat in het gewichtsdragend deel van de heup heeft bijzondere nadelen, waaronder het optreden van botoedeem en pijn bij het belasten van de heup. In die zin lijkt het aanboren van andere bronnen voor het bekomen van mesenchym(stam-)cellen voor de behandeling van kraakbeenletsels logischer.
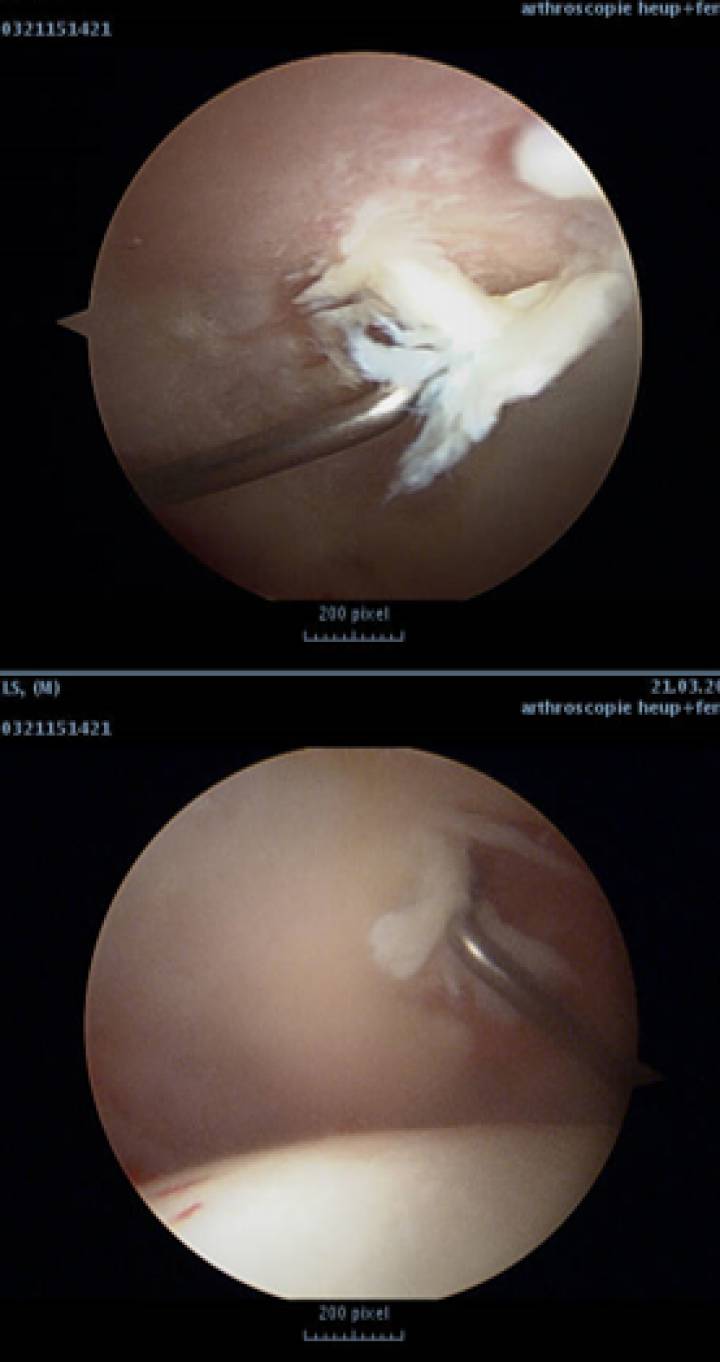
Een bijzonder moeilijk te behandelen kraakbeenletsel in de heup is het zogenaamde “wave sign” of “bubble sign” aan de acetabulaire rand. Het betreft een delaminatie in situ van het kraakbeen, met intakte chondrolabrale junctie. Verscheidene technieken zijn beschreven geweest (waaronder convertering in full thickness letsel, retrograde drilling, retrograde plugs, shrinking, …) doch allen met onvoldoende succes. Sedert meer dan 10 jaar gebruikt de auteur een techniek van fixatie dmv Tissuecoll, die achter het gedelamineerde kraakbeen ingebracht wordt. Ook andere auteurs zoals R Field hebben deze techniek de voorbije jaren occasioneel toegepast. R Field heeft enkele resultaten van biopsies gerapporteerd en heeft aangetoond dat het kraakbeen bij delaminatie nog viabele chondrocyten bevat in de onderste laag, doch substantieel minder. Er zijn geen klinische studies bekend tot op heden betreffende de hogergenoemde techniek van kraakbeen(her)fixatie in de heup. De ervaring van verscheidene “high volume” arthroscopisten leert dat deze techniek beterschap brengt bij vele patiënten, doch dat een intensieve belasting van het gewricht meestal onmogelijk is. Heling met aanwezigheid van hyalien kraakbeen gefixeerd aan het subchondrale bot kon tot nu toe niet aangetoond worden. Deze gegevens (APO + klinische ervaring) doen besluiten dat het letsel wel enigszins gestabiliseerd wordt, doch dat er geen heling optreedt.
Reeds in 1987 werd ACI (Autologeous Chondrocyte Implantation) beschreven in de knie. De techniek werd FDA approved in 1997. De middellange en lange termijn resultaten zijn ondertussen gekend in de knie. Gezien de initiële problemen en technische moeilijkheden met periost, werden collageenmembranen ontwikkeld om de chondrocyten bekomen bij kweek te “hosten”. We spreken van MACI: ACI waarbij een matrix (meestal collageenmembraan) gebruikt werd. Dit is ondertussen de standaard techniek bij ACI.
Er zijn ondertussen heel wat studies gepubliceerd over AMIC: Autologeous Matrix Induced Chondrogenesis. Hierbij wordt gebruikt gemaakt van een matrix die ingebracht wordt in het kraakbeendefect, en waarbij lokale mesenchymcellen, bloedplaatjes, en lokale cellen die vrijkomen bij de techniek van microfracturing een betere omgeving vinden voor heling. De klinische resultaten van AMIC zijn beschreven in de knie, de heup en het enkelgewricht. Een nieuwe scaffold werd beschreven in een level 1 studie die een betere “fill” van het kraakbeendefect aantoont (BST CarGel®). De meeste studies betreffen een collageenmembraan type ChondroGide®. Belangrijk is op te merken dat de heling van het kraakbeenletsel bij AMIC voornamelijk gebeurt door fibrocartilago.
Een vergelijkende studie van Fontana kon in de heup aantonen dat AMIC met het gebruik van ChondroGide® op middellange termijn betere resultaten gaf dan microfracturing. Een vergelijkende studie van Somers kon eveneens bij CAM-type FAI in de heup aantonen dat er significant minder postoperatieve synovitis en vochtuitstorting was bij AMIC voor middelgrote en grote kraakbeenletsels. Eveneens werd aangetoond dat er een betere sporthervatting was bij de AMIC groep vs microfracturing.
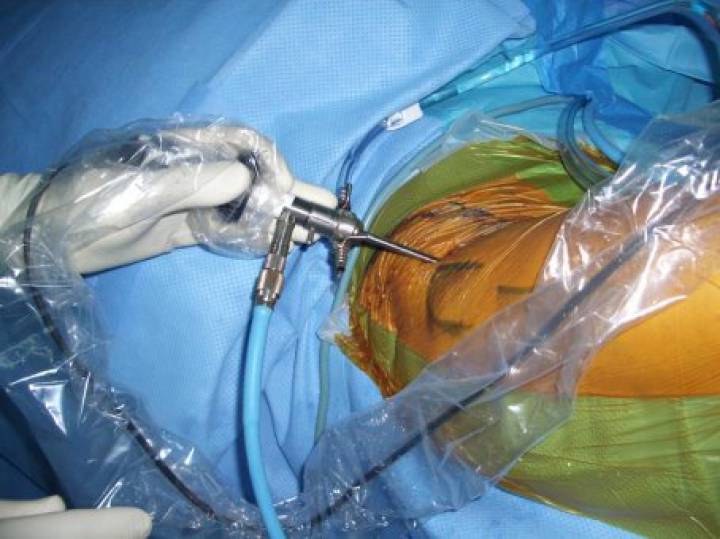
Het is de logica zelve dat de laatste jaren de focus verschoven is naar het bekomen van betere heling (hyalien kraakbeen) en het beïnvloeden van de heling door toevoegen van biologische factoren. De meeste toepassing momenteel betreft het verhogen van de aanwezigheid van mesenchymcellen (stamcellen). Mesenchymcellen kunnen bekomen worden uit beendermerg, vet en synovium. Enkel het beendermerg bekomen uit de bekkenkam bevat een voldoende hoge concentratie aan mesenchymcellen (BMAC – Bone Marrow Aspirate Concentrate). Bij liposuctie kan een zeer hoge concentratie van mesenchymcellen bekomen worden uit het vasculair stroma. Beide technieken geven onmiddellijk een voldoende hoeveelheid mesenchymcellen voor klinisch gebruik. Lipogems® techniek maakt gebruik van de viabele pericyten van het vasculaire stroma die na crush injury loskomen van de capillairen en transformeren tot geactiveerde mesenchymcellen. Deze secreteren groeifactoren , cytokines, exosomen, proteinen en peptiden die allen nuttig zijn bij de kraakbeenheling. Vanuit het synovium kunnen ook stamcellen bekomen worden door kweek.
Er zijn voldoende experimentele data om aan te tonen dat het gebruik van BMAC aanleiding kan geven tot het optreden van heling met hyalien kraakbeen ipv fibrocartilago.
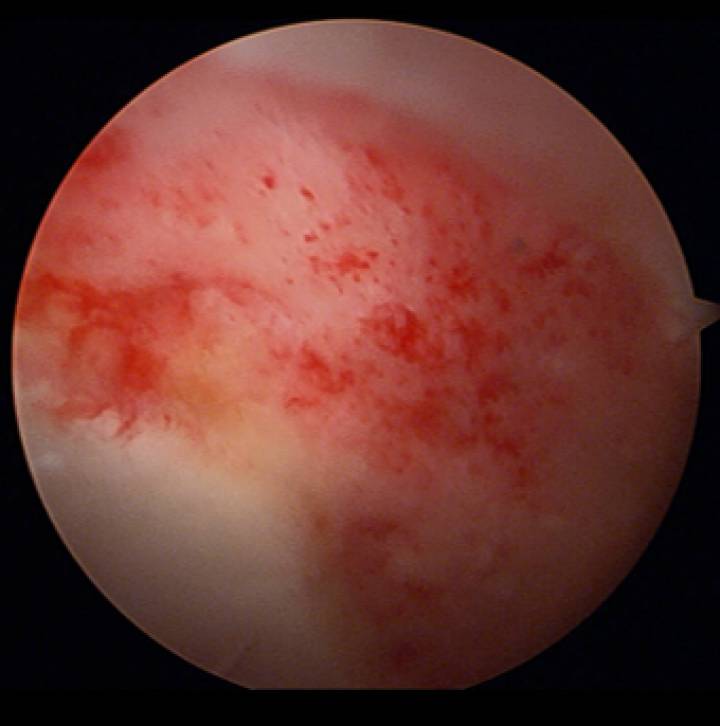
De auteur gebruikt met succes stamcelconcentraat met IORG-1 in de behandeling van kraakbeenletsels in de heup als supplementaire biologische “enhancer” bij AMIC sedert 2014. Er werden tot op heden geen adverse events waargenomen. Een recente studie van Somers toonde na 4 jaar >95% succesvolle outcome van AMIC + BMAC in een sportieve populatie van patiënten met ernstige kraakbeenletsels in de heup.
Samenvatting:
Er zijn verscheidene studies die het nut van een matrix aantonen bij grotere (>100mm) kraakbeenletsels.
Er zijn klinische studies met zeer gunstige resultaten op middellange termijn voor het gebruik van BMAC + matrix (Chondrogide).
Een recente rapportering toonde anatomopathologisch hyalien kraakbeen aan 1 jaar na behandeling van acetabulaire delaminatie met intakte chondrolabrale junctie in de heup (zgn “bubble of wave sign”) met Lipogems®. Dit zou een veelbetekenende stap voorwaarts kunnen zijn gezien de beperkte resultaten tot op heden (cf supra).
Besluit
In conclusie kunnen we stellen dat er voldoende gegevens voorhanden zijn om het gebruik van een matrix (collageenmembraan type ChondroGide® of BSTCarGel®) en BMAC (en/of Lipogems) te verdedigen bij gelokaliseerde middelgrote en grote kraakbeenletsels bij jonge patiënten (AMIC techniek). In de heup kunnen we de grens leggen op 100mm².
Eveneens zijn er voldoende argumenten om het belang aan te tonen van een oorzakelijke behandeling: het opheffen van malalignement, het behandelen van instabiliteit, en het behandelen van beenderige impingement. In de heup betekent dit een correctie van de onderliggende FAI indien aanwezig (>90% van alle patiënten met gelokaliseerde kraakbeenletsels).
ACI wordt meer en meer verlaten owv de hoge kostprijs én owv het feit dat 2 chirurgische ingrepen noodzakelijk zijn. Behandeling van kraakbeenletsels in 1 tijd verdient de voorkeur indien mogelijk. Er zijn trouwens gegevens die aantonen dat AMIC en het gebruik van stamcelconcentraat vergelijkbare resultaten kan opleveren.
Dr Somers 2019
Resultaat AMIC + BMAC